CRISPR
La Cina verso eserciti di supersoldati geneticamente modificati resistenti alle radiazioni

Un team di scienziati medici militari in Cina ha affermato lo scorso marzo di aver inserito un gene di tardigrado a nelle cellule staminali embrionali umane e di aver aumentato significativamente la resistenza di queste cellule alle radiazioni. Lo ha riportato il giornale di Hong Kong South China Morning Post.
I tardigradi sono esseri microscopici invertebrati detti anche estremofili, per la loro capacità di sopravvivere in condizioni estreme. Diffusi su tutto il pianeta e capaci di resistere per periodo molto lunghi in stato di congelamento o disseccamento, sono riscontrabili in Antartide come negli abissi degli Oceani e pure in Himalaya a 6000 metri.
«Il team cinese dietro l’esperimento sui geni degli animali estremofili afferma che potrebbe portare a super soldati che sopravvivono al fallout nucleare» scrive il quotidiano di Hong Kongo.
Il progetto è stato presentato per la prima volta su una rivista di scienze mediche militari in lingua cinese e sta guadagnando sempre più attenzione e interesse da parte dei media all’interno della comunità scientifica, ma sta anche sollevando seri dilemmi etici, nonostante l’esperimento sia difeso dai suoi supervisori come «totalmente legale».
Secondo i dettagli, gli scienziati militari affermano di aver «inserito con successo un gene del microscopico orso d’acqua nelle cellule staminali embrionali umane e di aver aumentato significativamente la resistenza di queste cellule alle radiazioni».
I ricercatori «hanno detto che il successo in questo esperimento senza precedenti potrebbe portare a soldati super resistenti che potrebbero sopravvivere alla ricaduta radioattiva», scrive il SCMP. L’iniziativa prevedeva l’introduzione sperimentale nel DNA umano (utilizzando cellule embrionali) di un gene chiave trovato nei tardigradi. Il gene in questione conferisce alla microscopica creatura una rara resistenza alle radiazioni e ad altri effetti ambientali estremi.
Gli scienziati hanno a lungo considerato che i tardigradi possano custodire segreti genetici che un giorno potrebbero essere la chiave per la sopravvivenza e la longevità umana. Il minuscolo animale a otto zampe «sono in grado di sopravvivere in una pentola di acqua bollente, sul fondo di una trincea sottomarina o anche nel vuoto freddo e oscuro dello spazio» scrive il giornale. «Ad agosto, un veicolo spaziale israeliano che trasportava tardigradi come parte di un esperimento scientifico si è schiantato sulla luna e gli scienziati ritengono che potrebbero essere sopravvissuti».
Dopo aver isolato il gene del tardigrado in grado di produrre proteine simili a scudi in grado di proteggere dalle radiazioni e altri danni, il team cinese ha affermato di aver «trovato un modo per introdurre questo gene nel DNA umano utilizzando CRISPR-Cas9, uno strumento di modifica genetica ora disponibile nella maggior parte dei biolaboratori», scrive il quotidiano di Hongo Kong. «Nel loro esperimento di laboratorio, quasi il 90% delle cellule embrionali umane portatrici del gene tardigrado è sopravvissuto a un’esposizione letale ai raggi X, secondo il team guidato dal professor Yue Wen con il laboratorio di biotecnologia delle radiazioni presso l’Accademia delle scienze militari, Pechino».
Il team di scienziati, tuttavia, riconosce alcune enormi «incognite» sul percorso: «l’aggiunta di un gene alieno dell’orso d’acqua nelle cellule embrionali umane potrebbe portare a mutazioni dannose, o addirittura uccidere le cellule a causa del divario genetico tra le due specie, un rischio di cui il team di Yue era a conoscenza, secondo il loro articolo (…) Le proteine di schermatura sono “uniche per i tardigradi. La risposta immunitaria dopo l’espressione tra specie è sconosciuta e può portare ad alcuni problemi di sicurezza”».
I ricercatori prevedono quindi una possibile applicazione futura della loro tecnica di manipolazione genetica incentrata su esperimenti con le creature estremofile in casi relativi al trattamento della malattia acuta da radiazioni per i primi soccorritori, personale militare o chiunque si trovi vicino a una zona di fallout nucleare, ipotizzando anche l’era del futuro «super soldato» e degli esseri umani geneticamente modificati in grado di sopravvivere all’apocalisse nucleare.
Come riportato da Renovatio 21, la Cina – hanno accusato apertamente i funzionari dell’Intelligence americana – sta lavorando alacremente da anni alla produzione di supersoldati geneticamente modificati.
Come noto, la Cina, per lo meno pubblicamente, è il primo Paese ad aver impiegato la tecnica di ingegneria genetica CRISPR per il potenziamento degli esseri umani – le famose gemelline eugenetiche del biofisico He Jiankui, le quali sono state prodotte agendo su un gene che le rende immuni all’AIDS e, cosa meno conosciuta, fornisce loro capacità cerebrali superiori.
Bizzarramente, un anno fa era emerso come in Cina vi fossero esperti che stanno iniziando a produrre regole sul benessere dei bambini cinesi geneticamente modificati.
Il dottor He, nel frattempo, è stato scarcerato, partecipa a documentari e rilascia interviste, mentre le ricerche CRISPR ricevono milionate di dollari – e relativa, grottesca pubblicità personale natalizia – dall’immancabile Bill Gates.
L’eugenetica non è una brutta parola in Cina. Yousheng, lemma formato dal carattere 优 (yōu) che significa «eccellente, superiore» e da 生 (shēng) che significa «nascere, far nascere, vivere» – volendo, traduciamo pure come «nascita superiore» o «vita superiore», cioè «supernascita».
Come riportato da Renovatio 21, Pechino vuole salvare il tasso di natalità, ora in picchiata nonostante la fine della legge sul figlio unico, facilitando e sovvenzionando la riproduzione artificiale, liberalizzando la provetta persino per le donne single.
Chiunque dubiti delle mire eugenetiche della Cina si ricordi il caso del cestista Yao Ming. Già prima delle biotecnologie di manipolazione genica, un’eugenetica sportiva sarebbe stata intentata nel caso dell’altissimo e celeberrimo cestista di Shanghai Yao Mingo. Come scrive il libro Operation Yao Ming, Ming nacque dall’accoppiamento, caldamente incoraggiato dal Politburo, dell’uomo più alto della città con una campionessa di pallacanestro. Il risultato fu eccellente: 2,29 metri di altezza, e carriera nell’NBA.
Dallo spilungone dell’NBA, alle supergemelle di He Jiankui agli eserciti di supersoldati radiazione-resistenti, il passo è così lungo, dite?
CRISPR
Terapia genica CRISPR per il colesterolo, paziente morto
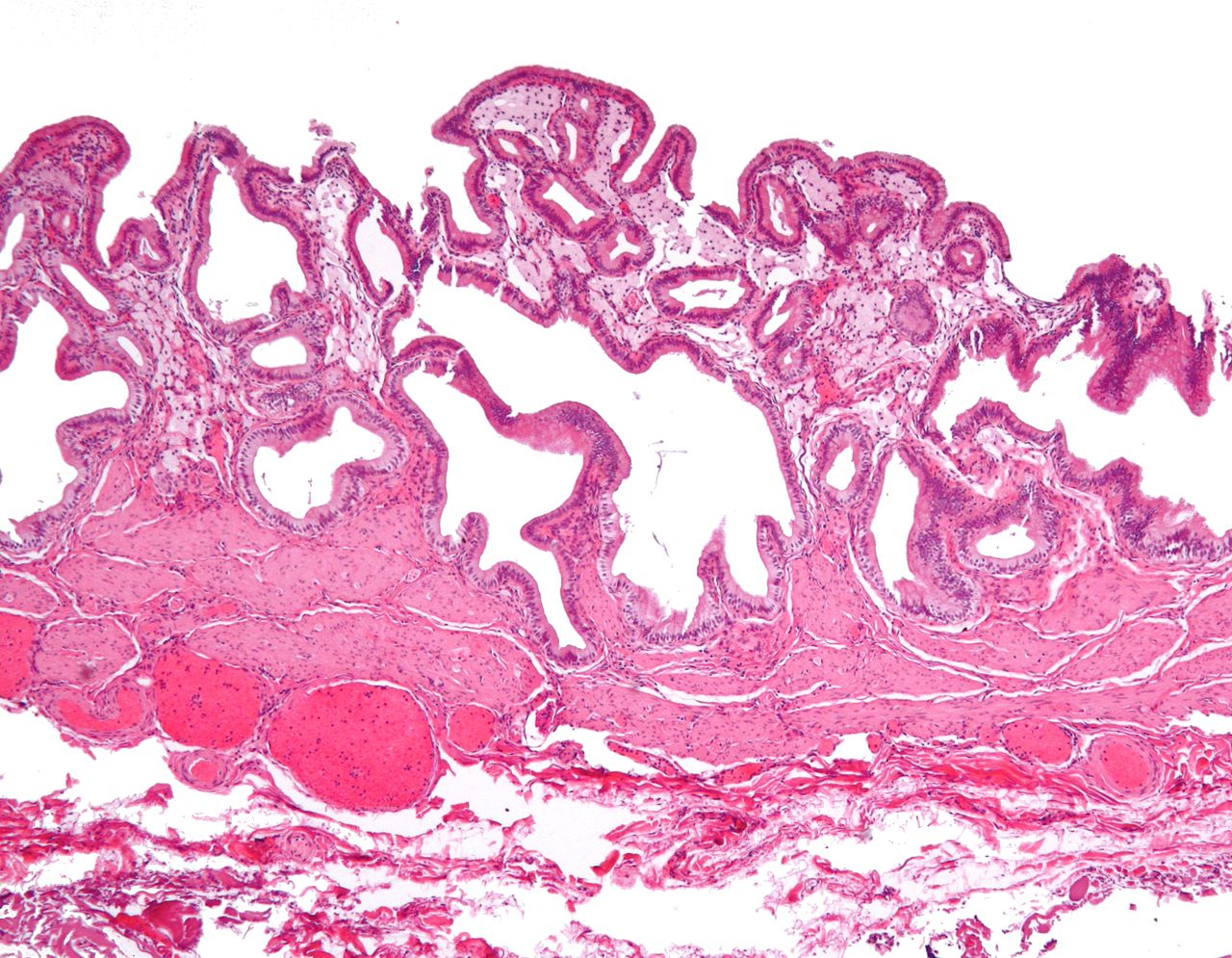
I ricercatori sono stati in grado di ridurre drasticamente il livello di colesterolo cattivo nei soggetti umani dopo avergli iniettato un trattamento sperimentale di editing genetico. Lo riporta la rivista scientifica Nature.
Si tratta della prima volta che questa tecnica, chiamata editing di base, è stata eseguita sugli esseri umani. Tuttavia almeno una persona è morta dopo aver ricevuto il siero di terapia genica sperimentale.
Nello studio clinico, a 10 soggetti con livelli congenitamente alti di colesterolo «cattivo» – ossia il colesterolo LDL (lipoproteine a bassa densità – è stata somministrata un’iniezione di VERVE-101, un trattamento di modifica genica che utilizza la tecnica di modifica di base. Questo trattamento ha quindi spento il gene per la proteina PCSK9, che si trova nel fegato e regola il colesterolo LDL. Alti livelli di LDL possono portare a malattie coronariche.
La modifica di base sfrutta gli strumenti di bioingeneria CRISPR per cambiare o modificare parti specifiche di un gene in mosse precise che evitano di rompere i doppi filamenti di DNA, a differenza delle precedenti tecniche di modifica del gene.
Sostieni Renovatio 21
I risultati, dice lo studio, sarebbero promettenti, con i soggetti dei test che hanno visto il loro LDL tagliato fino al 55% dopo 28 giorni. Prima dell’esperimento, avevano un LDL medio di 193 mg/dL, che è alto e può essere pericoloso per la vita. Le persone dovrebbero avere meno di 100 LDL, secondo gli standard medici.
Sei mesi dopo l’iniezione, i partecipanti che hanno ricevuto una dose elevata di VERVE 101 hanno ancora goduto di livelli di LDL più bassi.
Tuttavia il trattamento genico sperimentale ha mostrato diversi effetti collaterali: i partecipanti allo studio hanno riportato un breve attacco di brividi, febbre e mal di testa, oltre a un aumento transitorio dei livelli di enzimi epatici.
Spicca tra gli esiti dell’esperimento il fatto che dei 10 pazienti del test, un soggetto è morto per un attacco di cuore circa cinque settimane dopo aver ottenuto VERVE-101, mentre un secondo partecipante ha avuto un attacco cardiaco non fatale un giorno dopo l’iniezione. Nature ha riferito che un gruppo di sicurezza di esperti di terze parti ha affermato che l’infarto fatale non era dovuto a VERVE-101 e stavano già soffrendo di «malattie cardiache avanzate».
Esattamente come per le miocarditi da terapia genica sperimentale COVID (il cosiddetto vaccino mRNA), anche qui nessuna correlazione.
La società di biotecnologie Verve Therapeutics di Boston, Massachusetts, prevede di lanciare una sperimentazione clinica di fase 2 di VERVE-101 nel 2025, stando sempre a quanto scritto su Nature.
VERVE 101 è costituito da due molecole di RNA all’interno di una nanoparticella lipidica. Una molecola annusa il gene PCSK9 mentre l’altro RNA modifica il gene stesso. Quando VERVE 101 viene iniettato in un soggetto di test umano, il pacchetto si dirige verso i nuclei delle cellule del fegato, dove la molecola di modifica dell’RNA fa un cambiamento preciso al gene PCSK9 alterando una delle sue basi nucleotidiche. Questa mossa provoca la disattivazione del gene PCSK9, e quindi il fegato smette di produrre proteine PCSK9, innescando una riduzione dei livelli di LDL.
Il lavoro ripropone molte delle incognite su come l’editing genetico avrà un impatto sul resto del corpo umano. Il team di ricerca seguirà i soggetti dei test sopravvissuti per i prossimi 14 anni per scoprirlo.
Iscriviti alla Newslettera di Renovatio 21
Immagine di Nephron via Wikimedia pubblicata su licenza Creative Commons Attribution-Share Alike 3.0 Unported
CRISPR
Umani geneticamente modificati? Londra approva la terapia CRISPR per curare le malattie del sangue

Sostieni Renovatio 21
Come funziona il trattamento?
Per entrambe le malattie, il trattamento viene somministrato prelevando cellule staminali produttrici di sangue dal midollo osseo del paziente e modificando i geni utilizzando CRISPR, noto anche come CRISPR/Cas9, dal nome della proteina utilizzata per tagliare il DNA. La tecnologia prende di mira un gene chiamato BCL11A che tipicamente interrompe la produzione di un tipo di emoglobina tipicamente prodotta solo dai feti. Il Cas9 localizza il gene e taglia i filamenti del DNA per far sì che il gene smetta di funzionare. Nel processo, scatena la produzione di emoglobina fetale, che non presenta le stesse anomalie dell’emoglobina adulta nelle persone affette da tali disturbi del sangue. Prima del trattamento, i pazienti vengono sottoposti a un trattamento intenso e rischioso chiamato «condizionamento mieloablativo», che prepara il loro corpo a ricevere le cellule geneticamente modificate. Le cellule geneticamente modificate vengono quindi reinfuse nel corpo dopo essere state modificate. Potrebbe essere necessario che i pazienti trascorrano mesi in ospedale prima e dopo il trattamento. Il trattamento sarà probabilmente molto costoso – circa 2 milioni di dollari – mentre entriamo nella cosiddetta «era delle cure genetiche one-shot e multimilionarie», anche se le aziende non hanno indicato il prezzo.«Basta una sola cellula all’interno di un ampio pool di cellule modificate per… provocare il cancro»
Sebbene la maggior parte della copertura mediatica abbia celebrato i nuovi trattamenti basati su CRISPR, la ricerca scientifica ha sollevato preoccupazioni sull’uso della tecnologia, che può causare gravi danni genetici. Ciò può verificarsi, ad esempio, quando la cellula inizia a ripararsi dopo il taglio iniziale mirato a CRISPR, indipendentemente da quanto «preciso» possa essere quel taglio. Gli studi hanno scoperto che le modifiche CRISPR intese a eliminare la funzione di un gene non sono riuscite a farlo. Invece, hanno danneggiato i geni, provocando mutazioni sconosciute. In altri casi, CRISPR ha effettuato delezioni inaspettatamente grandi, causando danni genetici maggiori di quanto si pensasse in precedenza. Michael Antoniou, Ph.D., capo del Gene Expression & Therapy Group al King’s College di Londra, ha dichiarato a The Defender: «È risaputo che l’editing genetico CRISPR/Cas9 non è solo soggetto a danni genetici fuori bersaglio, ma anche a un’ampia gamma di mutazioni involontarie anche nel sito di modifica previsto. Ciò può avere un impatto negativo sulla funzione di più geni, che può portare al cancro». «È quindi fondamentale che i responsabili della somministrazione della terapia di editing genetico conducano un’analisi imparziale dell’intero genoma dei pazienti trattati per individuare mutazioni del DNA potenzialmente dannose per la vita. Questo è essenziale poiché basta una sola cellula all’interno dell’ampio pool di cellule modificate per andare storte e causare il cancro». Gli studi clinici non hanno riscontrato il cancro in nessuno dei soggetti, ma il gruppo di prova era piccolo e i pazienti sono stati seguiti solo per 16 mesi. Vertex ha affermato che prevede di seguire i soggetti della sperimentazione clinica per 15 anni, ma ha detto alle autorità di regolamentazione che «non vedono alcun motivo per trattenere il trattamento», ha riferito il New York Times. Alexis Komor, membro del comitato consultivo della Food and Drug Administration (FDA) statunitense, ha osservato che possono sempre essere effettuati ulteriori studi sulla sicurezza e che non aveva senso «aspettarsi la perfezione a scapito del progresso».Iscriviti alla Newslettera di Renovatio 21
CRISPR per il colesterolo alto? Il CEO di un’azienda biotecnologica che sviluppa un trattamento spera che un giorno tutti lo prendano
Un secondo trattamento medico CRISPR ha fatto notizia questa settimana quando i ricercatori hanno riferito che 2 partecipanti su 10 hanno avuto attacchi di cuore – e uno di questi è morto – nel primo studio sull’uomo che utilizzava una tecnica derivata da CRISPR nota come «base editing» per ridurre il colesterolo. Eppure lo studio, presentato domenica scorsa al convegno dell’American Heart Association, è stato salutato come «una potenziale prova di concetto fondamentale» da NPR e mostra «risultati promettenti» da Nature e come una «svolta decisiva» da Science perché ha ridotto la quantità di lipoproteine a bassa densità (LDL), o «colesterolo cattivo», nel sangue dei partecipanti sopravvissuti allo studio fino al 55%. La FDA ha concesso l’approvazione a Verve Therapeutics , la società biotecnologica dietro il trattamento, per arruolare pazienti statunitensi per partecipare alla fase successiva dello studio senza modifiche al protocollo del farmaco. Gli investitori sono stati più cauti. Il prezzo delle azioni della società è sceso del 37% nelle negoziazioni pre-mercato in seguito alla presentazione dei risultati del test. Il trattamento riscrive il codice genetico all’interno del corpo utilizzando una trasfusione di sangue per fornire un editor di base progettato per disattivare una proteina del fegato che regola l’LDL. Verve ha riportato i risultati provvisori di uno studio di fase 1b sul trattamento, condotto nel Regno Unito e in Nuova Zelanda, sul suo sito web e al meeting dell’American Heart Association e ha annunciato che continuerà lo studio l’anno prossimo negli Stati Uniti. Questa tecnologia viene pubblicizzata come «super precisa», ma ciò non è accurato, secondo John Fagan, Ph.D., capo scienziato e amministratore delegato del laboratorio indipendente senza scopo di lucro Health Research Institute. Fagan ha detto a The Defender che «l’editing genetico è “diretto” nel senso che può essere programmato per apportare specifici cambiamenti voluti nel DNA, ma, insieme alle modifiche genetiche previste, spesso si verificano effetti indesiderati “fuori bersaglio”, che possono essere dannoso per la salute e perfino per la sopravvivenza». Verve ha condotto la sua sperimentazione su persone affette da ipercolesterolemia familiare eterozigote (HeFH), una malattia genetica che causa elevati livelli di LDL fin dalla nascita. Ma Verve spera che il trattamento venga utilizzato come alternativa una tantum all’uso quotidiano delle statine da parte di decine di milioni di persone con diagnosi di colesterolo alto. Il CEO di Verve, Sekar Kathiresan, ha detto a Science che spera che un giorno possa essere somministrato agli anziani più in generale per scongiurare le malattie. «Più avanti, forse quando compirai 50 anni, questo è ciò che farai e ti allungherà la vita», ha detto Kathiresan. «Questa è la visione definitiva». Ma Fagan ha affermato che, dati i gravi rischi per la salute associati a questa tecnologia, non vi era alcuna giustificazione per una simile proposta. «Tali metodi dovrebbero essere usati solo come ultima risorsa», ha detto.Aiuta Renovatio 21
Le tecnologie basate su CRISPR vengono accelerate «con pericolosa arroganza»
Lo studio di Verve è il primo a utilizzare un trattamento di modifica di base negli esseri umani. CRISPR funziona tipicamente recidendo entrambi i filamenti di DNA e consentendo alle cellule di riparare la rottura. Gli editor di base, sviluppati nel 2016 dal laboratorio di David Liu all’Università di Harvard e dal Broad Institute, utilizzano la tecnologia CRISPR per alterare le singole basi nel codice genetico senza rompere entrambi i filamenti del DNA, un processo che secondo gli sviluppatori è più preciso. Sebbene alcune terapie geniche CRISPR siano state testate direttamente nel corpo umano, l’editing di base no. Il primo test di editing di base sugli esseri umani all’inizio di quest’anno ha rimosso le cellule dal corpo di una ragazza affetta da leucemia, le ha modificate in laboratorio e poi le ha reinserite nel suo corpo. Questa terapia inietta direttamente nelle persone il trattamento, progettato per disattivare permanentemente un gene nel fegato chiamato PCSK9, che controlla il colesterolo LDL. Ciò può aumentare il rischio di infarto e ictus. Verve ha arruolato 10 persone nello studio con HeFH, che colpisce circa tre milioni di persone negli Stati Uniti e in Europa. I partecipanti avevano una malattia coronarica e assumevano statine. Science ha spiegato come funziona il trattamento: «Il suo trattamento consiste nell’RNA messaggero (mRNA) che istruisce le cellule a produrre i componenti proteici dell’editor del gene. Confezionato in minuscole palline di grasso chiamate nanoparticelle lipidiche (LNP), utilizzate anche nei vaccini mRNA contro il COVID-19, viaggia verso il fegato, dove un ulteriore filamento di RNA trasportato anch’esso nelle particelle guida l’editor di base al gene per PCSK9». «La combinazione apporta un cambiamento di una coppia di basi in modo che le cellule possano produrre solo versioni accorciate e non funzionali dell’enzima». Ma J. Jay Couey, Ph.D., scienziato dello staff di Children’s Health Defense, ha dichiarato a The Defender che tali metodologie di trasfezione basate su LNP hanno una «debolezza cruciale» che le rende pericolose e che molti esperti, tra cui il Dr. Sucharit Bhakdi, Michael Yeadon, Ph.D. e Byram Bridle, Ph.D., evidenziamo da anni. «Un sorprendente punto in comune tra molti di questi esempi di tecnologia CRISPR accelerata è il presupposto che gli LNP possano essere utilizzati per “mirare” questi mRNA a cellule particolari» ha detto Couey. «Abbiamo dichiarazioni dell’inventore della tecnologia LNP, Pieter Cullis, che ammette liberamente di non poter indirizzare gli LNP verso un particolare tessuto.Sostieni Renovatio 21
Iscriviti alla Newslettera di Renovatio 21
CRISPR
Indi Gregory, i mitocondri, l’era umanoide

No, non abbiamo «preso il buco», come si dice in gergo giornalistico.
In questi giorni non abbiamo parlato mai di Indi Gregory non perché non conoscessimo il caso. Se non avete letto articoli a riguardo della tragedia della piccola inglese, non è che perché sdegniamo le cose riportate nella cronaca nazionale, perché concentrati sul quadro più grande, persi tra geopolitica e misticismi preconizzanti.
Lo confesso: ho avuto, per il caso, come un senso di ripulsa. Da un certo punto di vista, si tratta di una cosa personale: avevo seguito i casi di Charlie Gard e di Alfie Evans – e qualcuno dei seguenti: perché, lo avete capito, è un pattern molto finito definito, è un’iniziativa, come si dice nel business delle startup, «scalabile e ripetibile».
Devo dire che ero stato coinvolto, in quei casi di infanticidio inflitto dalla Corona britannica per mezzo dei suoi ospedali e dei suoi giudici parrucconi (letteralmente), fino a starne male. Non ero il solo: ricordo le lacrime di alcune amiche. Ricordo gli atti, mai raccontati da nessuna testata o blog che sia, di gruppi di persone che non si davano per vinte, arrivando ad attaccarsi ai cancelli del Vaticano.
Ricordo tutto quel turbine. Ricordo quando staccarono le macchine ad Alfie – e lui, invece di morire, rimase in vita. Per un po’.
Non scrivo per partecipare alla macchina di indignazione permanente, quella che i movimenti pro-life sperano di montare ogni volta, di modo di spillare da voi (e dalla TV) attenzione e danari. Non ho messo in piedi Renovatio 21 per far parte di quel circo, soprattutto perché ho capito che esso è solo un narcotico per i pochi che ancora conservano l’animo, è uno strumento di controllo, un sistema di sorveglianza che, dopo aver raggruppato le emozioni, le livella via.
Nulla era servito nel caso di Alfie. Non gli appelli, le mosse opportuniste dei politici, le visite dal papa (con volto funereo tipo quello che aveva con Trump). Nulla, soprattutto – come cercherò di dire in questo articolo – era stato imparato.
Quindi, il lettore capisca la mia ritrosia personale. E poi, quando vedo apparire Pillon col papillon e magari il sorrisetto, non è che posso farcela. Né mi potete chiedere di farcela.
Oltra a questioni intime, dicevo, c’è un altro aspetto, più astratto, come dire, epistemologico, biopolitico, di filosofia della storia, forse. Ci sono cose che penso, da anni, ma che non mi va dire, o ripetere. Perché, ci crediate o no, costa molto metterci la testa, tirarle fuori, e poi sentirsi deriso, o molto peggio, sentirsi solo, mentre fuori il mondo lancia coriandoli in un’altra direzione, in un’altra dimensione.
Una di queste cose è, in sintesi, l’idea per cui gli omicidi pubblici perpetrati dallo Stato contro questi bambini serve per avviare l’era in cui i bambini saranno tutti progettati geneticamente in provetta – materia in cui, nessuno ovviamente lo ha ricordato in questi giorni, Albione fu pioniera già 45 anni fa con Louise Browne, il primo test tube baby prodotto dal dottor Robert Edwards, quello che programmaticamente, disse, voleva sostituirsi a Dio nel controllo della vita.
Sostieni Renovatio 21
Nessuno, parimenti, ricorda che il Regno britannico è quello di Crick e Watson, gli scopritori del DNA, e di certi discorsi direttamente eugenetici primo. Francis Crick occasionalmente esprimeva idee come, ad esempio, quella secondo cui in cui i genitori benestanti dovrebbero essere incoraggiati ad avere più figli. «Al momento non è un argomento che possiamo affrontare facilmente perché le persone hanno così tante credenze religiose e finché non avremo una visione più uniforme di noi stessi penso che sarebbe rischioso provare a fare qualsiasi cosa in termini di eugenetica» scrisse il Crick, che disse che sarebbe «rimasto stupito se, nei prossimi 100 o 200 anni, la società non si convincesse che si dovrà cercare di migliorare la prossima generazione in una certa misura o in un modo o nell’altro».
Nessuno ha rammentato il tanto lavoro fatto dalla politica e dalla sanità inglese per stabilire e poi abbattere le regole per la coltivazione sperimentale di embrioni in vitro (come la «legge dei 14 giorni», dopo i quali l’embrione creato in laboratorio va scartato).
Nessuno pare, poi, voler parlare di chi sta sul trono di Londra, di quel re e di quella famiglia reale, che tante volte su Renovatio 21 abbiamo definito «famiglia della morte»: una dinastia di signori della Necrocultura globale, che – come in certi altri casati americani – pare trasmettersi geneticamente l’odio per l’umanità, e la missione della sua contrazione.
La cosa rivelatrice che abbiamo visto è il fatto che, vista la posizione presa dal governo italiano (ci torneremo prima di finire il pezzo), la sinistra italiana si è compattata per la morte della piccola. Sembra incredibile, se lo si pensa, ma è così: non cercano nemmeno di dissimulare, non dicono nemmeno più frasi di circostanza, non cercando di astenersi dal parlarne pubblicamente, visto che magari pure qualche elettore del PD poteva andare in dissonanza cognitiva… uccidere… una bambina?
No, il pudore della Cultura della Morte non esiste più, anzi. Esiste l’attrazione assoluta, del partito di sinistra divenuto «Partito radicale di massa» come profetizzava Del Noce, per gli argomenti di morte, perché vissuti come prove della propria virtù liberale: l’eutanasia è l’esempio più lampante, ma quella riguarda (in teoria, molto in teoria) persone che vogliono morire. Quei c’è una bambina piccolissima…
Su La7, polo televisivo del proprietario del Corriere della Sera a cui è stato lasciato assemblare un simile potentato giornalistico, sono andati in onda istruttivi interventi di Andrea Crisanti, l’unico della risma dei dottori del COVID-catodico a cui è riuscito il salto verso il Parlamento.
Crisanti era la persona giusta a cui chiedere lumi: per la massa bovina – cioè il vero destinatario delle comunicazioni di massa odierne, la massa vaccina – è la scienza incarnata. Nel curriculum ha anni vissuti in Inghilterra, dove all’Imperial College (ente recipiente dei milioni dei Gates, uno di quei casati di cui parlavo poche righe sopra) si ingegnerizzavano zanzare geneticamente modificate per il nobile compito di vincere la malaria – estinguendo la specie dopo averla resa sterile con la bioingegneria CRISPR – un’altra passione non tanto segreta di Gates.
Ascoltiamo cosa dice il senatore in un talk show: «dall’Inghilterra dobbiamo imparare tantissimo», perché «è la patria dell’habeas corpus, del rispetto dell’individuo… c’è stato un processo lungo otto mesi… la famiglia ha perso anche il ricorso al Consiglio di Europa e ha perso anche là… non è che stiamo parlando di uno Stato autoritario, guardi che l’Inghilterra è la patria della libertà… noi dall’Inghilterra dobbiamo imparare tantissime cose sulla libertà individuale».
In un’altra intervista sempre sul canale di Cairo, il Crisanti ha puntualizzato scientificamente la questione, spiegando che la patologia della bimba è «un’insufficienza metabolica dei mitocondri… se queste strutture non funzionano, praticamente tutti i tessuti del corpo si consumano come fosse una candela… di fatto è un progressivo deterioramento sia fisico che neuronale… non esiste cura».
«La bambina nel giro di pochi mesi muore… eh» dice il senatore. «Muore comunque, non ci ha speranza di vita».
Iscriviti alla Newslettera di Renovatio 21
La giornalista quindi chiede se c’è qualcosa che l’Italia dal punto di vista sanitario può fare più dell’Inghilterra. Il Crisanti scuote la testa «assolutamente no, lei consideri che la genetica è nata in Inghilterra. In Inghilterra ci stanno i più grandi specialisti di genetica umana e di terapia genica», assicura, con un certo accento centroitalico («derabbiaggeniga»).
«Quindi faccio fatica a credere che in Italia possa ricevere qualcosa in più che avrebbe potuto avere in Inghilterra» dice lo scienziato apparso a Padova, cioè a Vo’ Euganeo, nel primo focolaio COVID, e mai più toltosi dalla scena.
Il senatore PD dice di comprendere il dolore della famiglia, per poi dichiarare che «comprendo anche la posizione degli inglesi. Non dimentichiamoci che l’Inghilterra dell’habeas corpus, della libertà individuale. Cioè, stiamo di fronte ad un Paese civilissimo… la famiglia ha avuto tutte le garanzie possibili che la legge poteva offrire… hanno fatto appello anche alla Corte Europea, hanno perso anche alla Corte europea».
Insomma, i talking point sembrano essere sempre gli stessi, con il messaggio forse solo da noi percepito, e un po’ strano considerando che sono parole che vengono dalla bocca un senatore della Repubblica Italiana, di una sorta di superiorità scientifico-morale-legislativa di un Paese straniero. Insomma, per tutte queste ragioni, le macchine vanno staccate, farla venire in Italia è inutile, insomma Indi deve…
Fermi tutti, però qui è saltata fuori però una parola nuova: mitocondri. Ah già, i mitocondri. Déjà vu.
La sindrome da deplezione del DNA mitocondriale (in acronimo anglofono MDS, o MDDS) era esattamente la malattia di cui soffriva Charlie Gard, il bambino la cui storia lacerò il mondo, ucciso con il distacco delle macchine imposto dall’ospedale e dalla Sanità inglese, in combo con i giudici, nel 2017.
Forse, se leggete questo sito, già lo sapete: i britannici sono i primi ad aver permesso e realizzato la cosiddetta «donazione mitocondriale», espressione orwelliana talvolta preferita a «Three parents IVF», ossia «fecondazione in vitro a tre genitori». In pratica, si produce in laboratorio un bambino formato da tre genitori, frutto del materiale genetico di un uomo e due donne: la madre dà l’ovulo, ma una seconda donna, considerata sana, fornisce i mitocondri, sostituendo quelli difettosi della madre-ovocita.
Aiuta Renovatio 21
Ovviamente, non ci possono essere studi a lungo termine – anzi, c’è qualche possibilità che crei malattie inaspettate – ma, come altre terapie geniche che conoscerete, la si fa lo stesso, l’ultimo caso famoso è di sei mesi fa, proprio in terra di Albione. Per produrre un embrione che diventa il bambino a tre genitori, ricordiamo en passant, ne hanno distrutti 316. Ucraina e Singapore, e pure l’Australia, già da un lustro sono sul pezzo.
Abbiamo scritto su questo sito che c’è la grande probabilità che la provetta a tre genitori possa essere stata offerta ai Gard. Ciò vuol dire, che i bambini dopo Charlie potrebbero essere figli della provetta a tre genitori, perché, assicurano gli scienziati, è l’unico modo per non rischiare il ripetersi di quello strazio.
Fai il bambino in provetta, fondendo tre DNA (i mitocondri hanno un codice genetico loro, il DNA mitocondriale) per non avere problemi, anzi, guarda, fallo per il bene del bambino. Tenete a mente quale sarà il mantra per i bambini nati da bioingegnerizzazione: sarà come vaccinarli…
È chiaro che siamo dinanzi ad una delle prime svolte programmate per i designer babies, cioè per l’eugenetica del XXI secolo. È chiaro che ci stanno portando lì.
Per questo, ritengo, che scienziati e giudici del sistema della morte sono così insolitamente negativi rispetto alle cure. È per questo che il Moloch britannico, a costo di dividere l’opinione pubblica e creare qualche dissonanza cognitiva, sta ammazzando tutti questi bambini.
Charlie, Indi e gli altri sono i piccoli sacrifici umani sui quali si sta costruendo un mondo fatto solo di bimbi bioingegnerizzati, magari con il CRISPR, come le zanzare di Gates e Crisanti. Sangue innocente, versato per il sorgere dell’era umanoide.
Ci rendiamo conto che è tanta roba, ma è quello che pensiamo – da anni. Ed è per questo che viene da guardare infastiditi il circo che si è scatenato intorno a Indi. Gli occhi fissi sul dito, mentre la Luna è lì davanti, piena, immensa. E i lupi ululano.
Avevamo promesso due parole sulla Meloni, e il suo beau geste di dare la cittadinanza alla bambina, sperando di portarla in Italia. Rimembrate che accadde la stessa cosa con Alfie Evans, che divenne cittadino italiano, come deliberato il Consiglio dei Ministri nell’aprile 2018 su proposta del ministro degli Interni Macro Minniti e del ministro degli Esteri Alfano.
Alfano era il capo di un partito biodegradabile, ora sparito, chiamato Nuovo Centrodestra, formatosi da una scissione del Popolo della Libertà di Silvio Berlusconi organizzata, scrisse qualche giornale, con l’appoggio dell’episcopato. Alcuni pezzi di quel network democristiano, il continuum talvolta inspiegabile tra la politica e i vescovi (i Family Day…), sono stati trasferiti direttamente in Fratelli d’Italia: è il caso dell’ex deputata NCD Eugenia Roccella, finita a far il ministro della Famiglia per la Meloni, con il memorabile incipit dell’incarico ministeriale per cui la legge 194/78 non andava toccata).
Non sorprende, dunque, che anche all’attuale governo sia venuta la stessa idea, con pure lo stesso ospedale pediatrico vaticano implicato, il Bambin Gesù, che di mitocondri si occupa da un po’. E, considerando cosa sta accadendo alla Pontificia Accademia della Vita, non sappiamo dove la cosa potrebbe andare a finire.
Sorprende, invece, come i gruppuscoli pro-life e i commentatori cattopolitici o destroidi possano aver tripudiato dopo la scelta spettacolare del premier di dare il passaporto alla bambina. Nel senso: davvero, come si potuto prendere sul serio questa cosa?
Rendere Indi Gregory cittadina italiana non può non configurarsi come un atto di attrito nei confronti di Londra. O meglio: un affronto, un atto ostile vero e proprio.
Eppure, solo pochi giorni fa, come in tante altre occasioni tra G7, G20 e altro, Giorgia era lì con i bacetti sulla guancia del prime minister Rishi Sunak, l’indiano di cui enigmaticamente non conosciamo la casta, ma di cui, come sa il nostro lettore, sappiamo tante altre cose interessanti.
Ora, se uno Stato straniero decide di uccidere un cittadino italiano, si apre – si spera – una crisi diplomatica. Nella fantasia di un Paese funzionale, ci si attende che, alla peggio, si mandi un commando di incursori per l’esfiltrazione. Gli USA fanno così – in realtà, fanno numeri poderosi anche per i loro cittadini che hanno certi problemi con la giustizia, come Amanda Knox o il pilota del Cermis.
Se un altro Paese vuole uccidere una bambina italiana, cosa è lecito aspettarsi, dallo Stato romano? Con evidenza, i lanciatori di coriandoli meloniani non si attendevano nulla. Sapevano che in fondo era solo un teatrino politico, che la bimba era italiana per modo di dire.
Mica vogliamo metterci contro Albione, che è pure partner della NATO, ed è, come diceva il senatore PD che vive in una villa palladiana (stile assai amato oltremanica), «patria della libertà», e pure, ci viene da aggiungere, della massoneria – quella forza occulta che, sì, ha prodotto l’Italia unita.
Mica prendiamo sul serio questa cosa di Indi italiana. In fondo si tratta solo di una bambina, la sovranità di un popolo si misura con le dichiarazioni dei politici sul MES, mica nel difendere una cittadina innocente ed indifesa. No?
È questo pensiero che mi è insopportabile, che mi manda in bestia. È l’impotenza generale davanti alla palese realtà per cui lo Stato moderno altro non è che una macchina di morte, inarrestabile, imbattibile, necessaria, alla quale bisogna arrendersi, e accontentarsi delle farse – fatte sulla pelle dei bambini piccoli. È la sottomissione allo Stato-Moloch. È l’incorporazione della Necrocultura come sistema operativo della politica e della vita quotidiana.
In pratica, lo hanno accettato: anche a destra. Facciamo finta di curarci della questione, poi però lasciamo che ci uccidano la bambina.
Questa, teorizzo dentro di me da un po’, è chiaramente la fine dello Stato-nazione nel XXI secolo, e della barzelletta ancora circolante del «nazionalismo». Perché una Nazione, per essere tale, deve rispettare l’etimologia latina della parola: natio, «nascita». Una nazione che uccide i bambini, prima o dopo che nascano, non è più una Nazione. Una nazione che come sua base ha il contrario – la morte, specie dei più piccoli, degli ultimi, dei cittadini futuri – quale ragione ha di esistere?
Le nazioni moderne avanzano solo perché, come abbiamo già detto, sono in ultima analisi macchine automatiche, macchine di morte. In pilota automatico, a discapito delle loro stesse leggi (lo abbiamo imparato, duramente, nel biennio pandemico) e contro soprattutto i principi più fondamentali come la continuità della popolazione e la protezione dell’individuo, esse possono andare avanti, ancora per qualche tempo almeno.
Svuotata della vita umana, cosa può rimanere alla Nazione? Una risposta l’abbiamo già data nel corso di questo articolo: rimane alla macchina, da gestire, sfoltire, programmare, la vita umanoide.
Attorniati dal circo osceno che abbiamo visto, questi bambini sono stati sacrificati per la mutazione epocale dello Stato, e per l’alba dell’era umanoide.
E adesso, scusate, ma sto guardando le foto della bambina con i suoi genitori, e mi sale la spremuta d’occhi. Vi lascio a ridere, o a meditare, su quanto ho avuto da scrivere.
Vi assicuro, non ne avevo voglia.
Roberto Dal Bosco
Iscriviti alla Newslettera di Renovatio 21
Immagine da Twitter
-



 Cervello2 settimane fa
Cervello2 settimane fa«La proteina spike è un’arma biologica contro il cervello». Il COVID come guerra alla mente umana, riprogrammata in «modalità zombie»
-



 Salute1 settimana fa
Salute1 settimana faI malori della 16ª settimana 2024
-



 Pensiero1 settimana fa
Pensiero1 settimana faForeign Fighter USA dal fronte ucraino trovato armato in Piazza San Pietro. Perché?
-



 Spirito2 settimane fa
Spirito2 settimane faSinodo 2024, grandi manovre in favore dell’ordinazione delle donne
-



 Autismo2 settimane fa
Autismo2 settimane faAutismo, 28enne olandese sarà uccisa con il suicidio assistito: i medici la ritengono che «incurabile»
-



 Vaccini2 settimane fa
Vaccini2 settimane faVaccino mRNA sviluppato in 100 giorni, professore di medicina avverte: «possibile solo ignorando i diritti umani»
-



 Vaccini7 giorni fa
Vaccini7 giorni faLanciati i vaccini RNA monodose contro COVID e influenza per i bambini. I critici: «livelli di follia senza precedenti»
-



 Economia1 settimana fa
Economia1 settimana faAmazon abbandona il sistema senza casse nei negozi: si è scoperto che la sua IA era alimentata da 1.000 lavoratori umani













