Big Pharma
L’Australia si scusa con le vittime della talidomide. Quando lo farà per quelle di lockdown e vaccini?
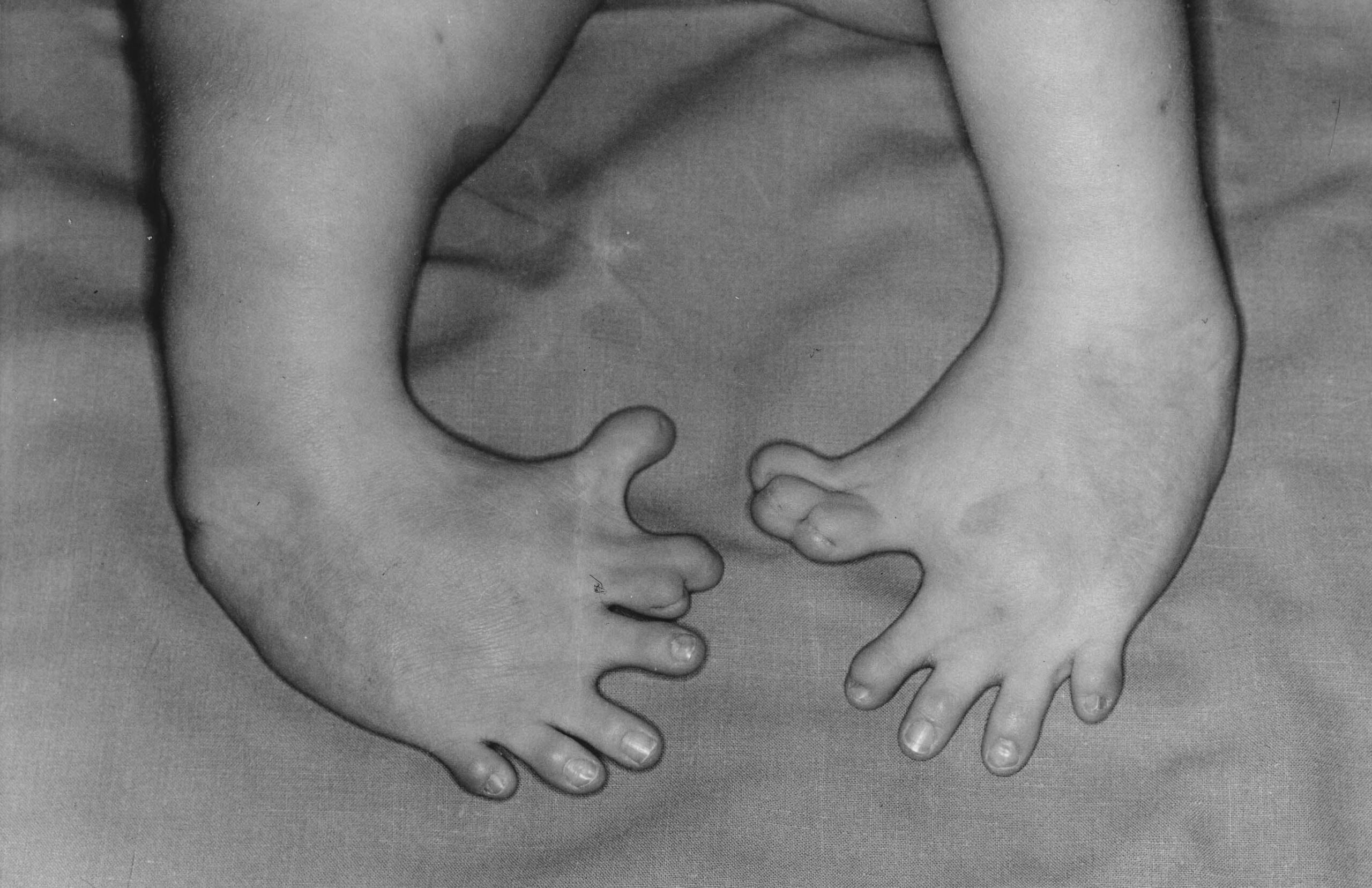
Il primo ministro australiano Anthony Albanese ha offerto le scuse nazionali alle vittime della talidomide, il farmaco contro la nausea mattutina che ha causato difetti alla nascita in circa 100.000 bambini in tutto il mondo. Le scuse segnano la prima volta che il governo australiano riconosce un ruolo nello scandalo.
«Ai sopravvissuti – ci scusiamo per il dolore che la talidomide ha inflitto a ognuno di voi ogni giorno. Ci dispiace. Siamo più dispiaciuti di quanto possiamo dire», ha detto Albanese mercoledì in Parlamento a un gruppo di sopravvissuti.
«Queste scuse si inseriscono in uno dei capitoli più oscuri della storia della medicina australiana», ha affermato.
Sviluppata dalla casa farmaceutica tedesca Grunenthal, la talidomide fu commercializzata tra il 1957 e il 1961 come cura per la nausea mattutina durante la gravidanza e come sonnifero che non crea dipendenza. Poco dopo essere stata immessa sul mercato, si è scoperto che la talidomide causava difetti alla nascita, inclusi arti accorciati o mancanti, mentre altre gravidanze venivano interrotte prematuramente dal farmaco e alcuni bambini esposti al farmaco nell’utero morivano prima di raggiungere la pubertà.
Le stime del Thalidomide Trust suggeriscono che circa 100.000 bambini con talidomide sono nati in tutto il mondo. Non è chiaro quanti siano stati colpiti in Australia, ma un rapporto del Senato di Canberra del 2019 ha rilevato che il 20% dei casi nel Paese avrebbe potuto essere evitato se il governo avesse agito prima per ritirare il farmaco dalla circolazione. Il governo non ha mai ammesso la responsabilità, ma ha offerto ai sopravvissuti pagamenti una tantum fino a 500.000 dollari australiani (332.000 dollari) e un risarcimento annuale fino a 60.000 dollari australiani nel 2019.
Schemi di risarcimento simili sono stati implementati in Canada nel 1991 e nel Regno Unito nel 2010. Grunethal riconosce il suo ruolo nello scandalo, ma non ha mai ammesso la responsabilità legale. Diversi funzionari della Grunethal furono accusati di omicidio colposo alla fine degli anni ’60, ma l’azienda si accordò in via stragiudiziale e accettò di contribuire ad una fondazione di beneficenza per le vittime.

Terry Wiles, immagine su licenza CC0
Sostieni Renovatio 21
Come riportato da Renovatio 21, cinque anni fa moriva in Australia il dottor William McBride, che fu tra i primi medici a dare l’allarme sulla talidomide – in pratica, un eroe che salvò chissà quanti bambini. Nonostante il suo ruolo fosse riconosciuto, per delle meccaniche che abbiamo imparato a conoscere quando si tratta di grandi interessi farmaceutici, il medico fu tuttavia attaccato ed emarginato nel corso del tempo, fino ad essere radiato dall’ordine dei medici – un’altra procedura che, purtroppo, abbiamo imparato a conoscere.
Nella primavera del 1961, al Crown Street Women’s Hospital di Sydney, in Australia, il Dr. McBride, un ostetrico, fece nascere un bambino che aveva malformato le braccia e altri problemi. Nel giro di poche settimane ne aveva visti altri due. In una lettera pubblicata sulla rivista medica The Lancet che in dicembre, notò che ciò che sembrava connettere le pazienti era un farmaco che aveva prescritto per la nausea mattutina, la talidomide (nota in Australia come Distaval).
Dopo aver fondato un’organizzazione di ricerca, la Fondazione 41, con un premio in denaro che aveva ricevuto da un istituto francese per il suo ruolo nella questione della talidomide, McBride fu oggetto di roventi polemiche. Negli anni Ottanta la sua ricerca sui possibili effetti dannosi di un altro farmaco, il Bendectin, fu messa in discussione e fu coinvolto in una lunga battaglia per difendere la sua reputazione.
McBride ed i suoi sostenitori credevano fermamente che le compagnie farmaceutiche stessero cercando di zittirlo, al punto da ipotizzare che stessero monitorando le sue telefonate: «ci sono crepitii ogni volta che parlo al telefono, che improvvisamente svaniscono o diminuiscono», disse al Sun-Herald di Sydney nel 1988. «Potrebbe non essere nulla, ma le compagnie farmaceutiche sono conosciute per ricorrere a metodi drastici per screditare coloro che appaiono in tribunale contro di loro».
«Non pensava che una compagnia farmaceutica non sarebbe stata felice di sentirlo quando ha detto: “C’è qualcosa di sbagliato nel tuo farmaco’” – ha detto la figlia Catherine McBride all’Australian –Pensava che avrebbe risparmiato loro un sacco di soldi».
Durante le controversie che seguirono, il dottor McBride sostenne di essere stato vittima di una campagna di Big Pharma per screditarlo. Nel 1987, per esempio, gli fu contestato l’uso dei conigli negli esperimenti e i relativi risultati. «Stiamo combattendo per alcuni conigli – disse al Sun-Herald – cosa è più importante – la vita di un bambino o quanto un coniglio ha bevuto in un esperimento?».
Fu così, che dopo tanti attacchi, nel 1993 un tribunale ordinò la sua radiazione registro medico dello Stato australiano del Nuovo Galles del Sud, impedendogli di praticare la medicina. Tuttavia, la radiazione dall’ordine finì per essere cancellata. McBride vinse il diritto di esercitare nuovamente la medicina nel 1998, anche se con diverse condizioni, tra cui quella di non condurre ricerche.
Iscriviti alla Newslettera di Renovatio 21
Ora, che il governo australiano chieda scusa alle vittime della talidomide è sicuramente positivo.
Tuttavia, ci chiediamo: quando chiederà scusa per la mostruosità raggiunta dal Paese durante il biennio pandemico?
Quando chiederà scusa per la repressione mostruosa contro la sua popolazione?
Quando chiederà scusa per la violenza delle forze dell’ordine portata – e autorizzata – fin dentro le automobili e persino le case delle famiglie?
Quando chiederà scusa per gli ordini che proibivano baci e abbracci a capodanno, i regali di Natale, e perfino le conversazioni?
Quando chiederà scusa per gli ordini ai nonni australiani di non avvicinarsi ai loro nipoti?
Quando chiederà scusa per gli insulti ai non vaccinati definiti dalle autorità sanitarie come «infelici» e «soli» per tutta la loro vita?
Quando chiederà scusa per la polizia che aggrediva perfino i bambini?
Aiuta Renovatio 21
Quando chiederà scusa per l’apartheid biotica effettiva implementata perfino nei supermercati?
Quando chiederà scusa per l’invito alla delazione per i vicini «anti-governo o teorici del complotto del vaccino COVID», che era ripetuto fino a pochi mesi fa?
Quando chiederà scusa per i lager?
Quando chiederà scusa per Melbourne, città offesa sino al parossismo, trasformatasi in una vera zona di guerra?
Quando chiederà scusa per le persone picchiate in strada perché prive di «documenti vaccinali»?
Quando chiederà scusa per i danni biologici che il vaccino sta producendo, come attestano gli interventi vari medici e qualche parlamentare, sugli australiani?
A tali domande non sappiamo rispondere, se non con un’esortazioni a coloro che agli antipodi sono rimasti umani: non facciamo passare altri 60 anni prima di vedere riconosciuta, a parole, la giustizia, la verità.
Chi ha ordito la catastrofe deve essere portato dinanzi alle sue responsabilità il prima possibile. In Australia come in Italia e in tutto il mondo.
Per quanto ci riguarda, lo abbiamo già detto: noi non dimentichiamo nulla.
Iscriviti alla Newslettera di Renovatio 21
Immagine di NCP14053 via Wikimedia pubblicata su licenza Creative Commons Attribution 2.0 Generic
Big Pharma
AstraZeneca ammette che il vaccino può provocare trombosi mortali: documenti giudiziari

Sostieni Renovatio 21
Iscriviti alla Newslettera di Renovatio 21
Aiuta Renovatio 21
Sostieni Renovatio 21
Iscriviti alla Newslettera di Renovatio 21
Big Pharma
Affermazioni fuorvianti sul vaccino Pfizer «hanno portato discredito» a Big Pharma: parla un autorità di autoregolamentazione britannica
Renovatio 21 traduce questo articolo per gentile concessione di Children’s Health Defense. Le opinioni degli articoli pubblicati non coincidono necessariamente con quelle di Renovatio 21.
La Prescription Medicines Code of Practice Authority, un organismo indipendente e di autoregolamentazione istituito dall’Associazione dell’industria farmaceutica britannica, ha stabilito che l’azienda ha violato cinque regole del suo Codice di condotta per la pubblicità.
Un’agenzia di regolamentazione del Regno Unito ha scoperto che i migliori dipendenti Pfizer «hanno portato discredito» all’industria farmaceutica quando hanno fatto affermazioni fuorvianti che promuovevano un «medicinale senza licenza» nei tweet sul vaccino COVID-19, ha riferito domenica The Telegraph.
La Prescription Medicines Code of Practice Authority (PMCPA), un organismo indipendente e di autoregolamentazione istituito dall’Associazione dell’industria farmaceutica britannica, ha stabilito che l’azienda avrebbe violato cinque regole del suo Codice di condotta per la pubblicità.
L’organismo di vigilanza dell’industria farmaceutica britannica UsForThem ha presentato un reclamo al PMCPA nel febbraio 2023. Il reclamo riguardava i tweet del 2020 dei massimi dirigenti Pfizer, tra cui il direttore medico britannico Berkeley Phillips. I tweet erano ancora visibili sui social al momento della presentazione della denuncia.
Sostieni Renovatio 21
L’organizzazione ha affermato che Pfizer «ha promosso in modo fuorviante e illegale il suo vaccino contro il COVID-19» riportando tassi di efficacia relativa molto elevati senza fornire informazioni sui tassi di efficacia assoluta o informazioni richieste sulla sicurezza.
UsForThem ha affermato che era importante presentare questa denuncia due anni dopo perché «tale comportamento scorretto era ancora più diffuso» di quanto si pensasse in precedenza, estendendosi «fino ai vertici» delle attività di Pfizer nel Regno Unito e «apparentemente continuando fino ad oggi».
Commentando l’importanza dei risultati, Daniel O’Conner di Trial Site News, che ha anche trattato la storia, ha dichiarato a The Defender: «il comportamento di Pfizer durante la pandemia è stato davvero scandaloso. E ovviamente l’obiettivo: grandi soldi».
O’Connor ha affermato che il «comportamento aziendale di Pfizer durante la pandemia», come rivelato da questa e altre sentenze del PMCPA, è «altrettanto insidioso» quanto i problemi con i percorsi normativi per i farmaci e i principali difetti negli stessi studi clinici che Trial Site News ha monitorato.
Pfizer ha una chiara esperienza di agire come «impresa di profitto inaccettabile durante la peggiore pandemia del secolo», ha aggiunto. «La domanda che abbiamo è chi ha dato loro potere nel governo».
Grave censura per aver portato «discredito su» Big Pharma
La denuncia si concentrava su un tweet che Phillips di Pfizer ha condiviso su Twitter, ora X, originariamente realizzato da un dipendente Pfizer con sede negli Stati Uniti.
Il tweet affermava:
«Il nostro vaccino candidato è efficace al 95% nella prevenzione del COVID-19 e al 94% nelle persone di età superiore ai 65 anni. Archivieremo tutti i nostri dati presso le autorità sanitarie entro pochi giorni. Grazie a tutti i volontari della nostra sperimentazione e a tutti coloro che combattono instancabilmente questa pandemia».
Il comitato investigativo della PMCPA ha scoperto che quattro dipendenti di Pfizer UK avevano ritwittato il post e altri lo avevano messo «mi piace». Hanno detto che probabilmente il pubblico e gli operatori sanitari avrebbero visto il tweet.
Iscriviti alla Newslettera di Renovatio 21
La giuria ha concordato con le accuse di UsForThem secondo cui il messaggio conteneva informazioni limitate sull’efficacia e nessuna informazione sulla sicurezza, in violazione delle regole sull’inganno del pubblico e sulla fornitura di dati accurati sulla sicurezza.
Il panel ha inoltre sottolineato che i codici di condotta esistenti vietano la promozione dei medicinali prima della loro autorizzazione all’immissione in commercio. Tuttavia, in diretta violazione dei codici, i tweet dei dipendenti Pfizer hanno portato alla «diffusione proattiva di un farmaco senza licenza su Twitter agli operatori sanitari e al pubblico nel Regno Unito», ha rilevato la commissione.
I tweet violavano anche la politica stessa di Pfizer che vieta ai dipendenti Pfizer di interagire con i social media relativi ai medicinali e ai vaccini dell’azienda.
Il comitato PMCPA ha concluso che «Pfizer ha portato discredito e ridotto la fiducia nell’industria farmaceutica», il che, secondo lui, è una seria censura che riserva a gravi violazioni come quella in cui un’azienda ha promosso un farmaco prima ancora che fosse stato autorizzato.
I casi che si ritiene abbiano portato discredito all’industria vengono pubblicizzati sulla stampa medica, farmaceutica e infermieristica.
Un portavoce di Pfizer UK ha affermato che la società «riconosce e accetta pienamente le questioni evidenziate da questa sentenza PMCPA» e che è «profondamente dispiaciuta», secondo The Telegraph.
Pfizer ha inoltre affermato che esaminerà l’uso dei social media da parte dei propri dipendenti per garantire che rispettino i codici attuali e per prevenire tali problemi in futuro.
Il giornale ha anche riferito che Phillips, il cui re-tweet era principalmente in questione, ha affermato che il post era «accidentale e non intenzionale». «Detto questo, abbiamo immediatamente accettato la sentenza del caso e facciamo tutto il possibile per garantire che i nostri dipendenti aderiscano alla nostra rigorosa politica sui social media e al Codice di condotta del settore quando utilizzano i loro social media personali» ha aggiunto.
Altri cinque rimproveri legati alla promozione del vaccino anti-COVID
Pfizer è stata rimproverata sei volte dall’autorità di regolamentazione per la sua promozione non etica del vaccino COVID-19.
Il 4 marzo, pochi giorni dopo che la PMCPA aveva annunciato la sua sentenza sui tweet del 2020 che promuovevano il vaccino, l’agenzia ha anche annunciato una seconda sentenza , rilevando che Pfizer aveva violato un’altra clausola del codice di condotta in un tweet del 2022 di Pfizer UK che «non è riuscita a mantenere standard professionali».
Tale sentenza, emessa anche in risposta a una denuncia presentata da UsForThem, riguardava una serie di tre tweet pubblicati sul feed Twitter di Pfizer UK che includevano un collegamento a un articolo di Pulse Today.
Aiuta Renovatio 21
Quel tweet diceva:
«Mentre il Regno Unito entra nel suo primo «inverno sbloccato» dal 2019, il nostro [dichiarato dipendente medico senior di Pfizer] spiega l’impatto devastante che le malattie respiratorie possono avere durante i mesi più freddi. Leggi di più @PulseToday  #WinterPressures».
#WinterPressures».
Il tweet rimandava a un articolo promozionale — ripubblicato qui — commissionato da Pfizer su un sito web per operatori sanitari, ma non era chiaramente contrassegnato come contenuto promozionale pagato da Pfizer.
Il PMCPA in questo caso ha affermato di essere preoccupato che i tweet fossero disponibili al grande pubblico mentre il materiale nell’articolo di PulseToday era destinato agli operatori sanitari. Ciò ha violato gli elevati standard creati dai codici di condotta, hanno affermato le autorità di regolamentazione.
Nel febbraio 2023, l’agenzia ha scoperto che il CEO di Pfizer Albert Bourla, Ph.D., ha rilasciato commenti «fuorvianti» e «non qualificati» promuovendo l’uso dei vaccini mRNA contro il COVID-19 per i bambini piccoli durante un’intervista alla BBC.
In quel caso, UsForThem ha accusato il redattore medico della BBC, Fergus Walsh, di aver condotto l’intervista «come un’amichevole chiacchierata davanti al caminetto», dando a Bourla «un’opportunità promozionale gratuita che il denaro non può comprare» permettendogli di promuovere la diffusione del vaccino, in particolare tra i giovani. bambini per i quali il vaccino non era stato nemmeno autorizzato.
All’epoca, nessun vaccino contro il Covid-19 era stato approvato dall’Agenzia di regolamentazione dei medicinali e dei prodotti sanitari del Regno Unito per i bambini sotto i 12 anni, quindi la commissione ha ritenuto che i commenti di Bourla violassero il codice.
Due delle altre sentenze del PMCPA su Pfizer riguardavano i post di LinkedIn e una riguardava affermazioni fatte in un comunicato stampa.
La sanzione per la serie di violazioni, ha riferito The Telegraph, è una multa di 34.800 sterline.
Ben Kingsley, responsabile degli affari legali di UsForThem, ha dichiarato al Telegraph che «è sorprendente quante volte i dirigenti senior di Pfizer siano stati ritenuti colpevoli di gravi violazioni normative, in questo caso incluso il reato più grave di tutti ai sensi del Codice di condotta del Regno Unito».
«Tuttavia le conseguenze per Pfizer e le persone interessate continuano ad essere ridicole. Questo sistema di regolamentazione senza speranza per un’industria della vita e della morte multimiliardaria è diventato una farsa, che ha un disperato bisogno di riforme», ha affermato Kingsley.
«È assolutamente necessaria una radicale revisione del quadro normativo e legale in base al quale questo settore distrutto e corrotto può operare», ha twittato UsForThem.
I critici negli Stati Uniti hanno chiesto che i regolatori nazionali ritengano Pfizer responsabile in questo caso. In un tweet, Jay Bhattacharya, MD, Ph.D. di Stanford., ha invitato la Food and Drug Administration statunitense a farlo.
James Lyons-Weiler, Ph.D., ha scritto che la Federal Trade Commission e la Security and Exchange Commission intraprendono azioni simili.
Brenda Baletti
Ph.D.
©8 aprile 2024, Children’s Health Defense, Inc. Questo articolo è riprodotto e distribuito con il permesso di Children’s Health Defense, Inc. Vuoi saperne di più dalla Difesa della salute dei bambini? Iscriviti per ricevere gratuitamente notizie e aggiornamenti da Robert F. Kennedy, Jr. e la Difesa della salute dei bambini. La tua donazione ci aiuterà a supportare gli sforzi di CHD.
Renovatio 21 offre questa traduzione per dare una informazione a 360º. Ricordiamo che non tutto ciò che viene pubblicato sul sito di Renovatio 21 corrisponde alle nostre posizioni.
Iscriviti alla Newslettera di Renovatio 21
Immagine di U.S. Secretary of Defense via Wikimedia pubblicata su licenza Creative Commons Attribution 2.0 Generic; immagine modificata.
Alimentazione
Pfizer sospende la nuova pillola dimagrante dopo che i pazienti hanno riscontrato gravi effetti collaterali

Sostieni Renovatio 21
Aiuta Renovatio 21
-



 Spirito2 settimane fa
Spirito2 settimane fa«Nostro Signore ha salvato questo coraggioso guerriero». Mons. Viganò commenta il tentato assassinio di Donald Trump
-



 Spirito2 settimane fa
Spirito2 settimane fa«Questa chiesa è una contraffazione»: omelia di mons. Viganò
-



 Gender2 settimane fa
Gender2 settimane faLa rete si interroga sul numero di agenti donne nella scorta di Trump
-



 Salute2 settimane fa
Salute2 settimane faI malori della 28ª settimana 2024
-



 Pensiero1 settimana fa
Pensiero1 settimana faLa scuola e l’eclissi della parola. Intervento di Elisabetta Frezza al convegno presso la Camera dei Deputati
-



 Predazione degli organi5 giorni fa
Predazione degli organi5 giorni faIl legame tra il concetto di «morte cerebrale» e la predazione degli organi
-



 Geopolitica2 settimane fa
Geopolitica2 settimane faMosca: le città europee sono i principali obiettivi dei missili russi
-



 Pensiero6 giorni fa
Pensiero6 giorni faNATO e mRNA, la Von der Leyen riconfermata per l’imminente guerra transumanista















